我国干细胞临床研究有按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定完成备案的项目,也有正在国家药品管理监督局药品审评中心进行注册申报的项目,还有一些新药临床研究申请已经获得批准的项目。
都有哪些干细胞治疗产品
进行了注册申报?
一、34个备案项目
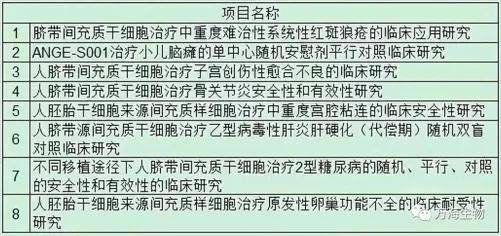
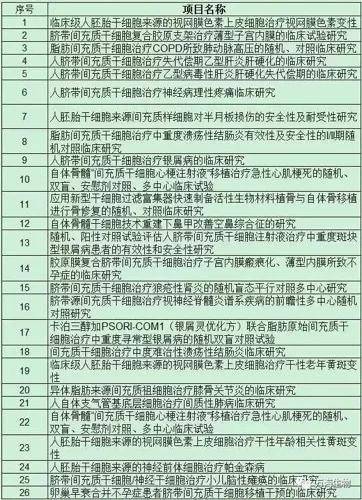
卫健委公布了新增的8个干细胞临床研究备案项目。加上医学研究登记备案信息系统上登记的26个干细胞临床研究备案项目,目前国内共有34个干细胞临床研究备案项目。
公布的8个新增备案项目
医学研究登记备案信息系统上的26个项目
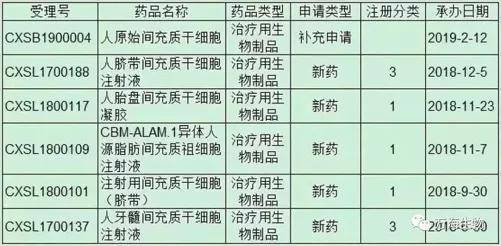
二、新增6个获受理项目
根据国家药品监督管理局药品审评中心的信息显示,去年6月至12月,共有5款干细胞治疗注册申报获得受理,所涉及的适应症包括膝骨关节炎、牙周炎如慢性牙周炎所致骨缺损、移植物抗宿主病、慢性创面(糖尿病溃疡等)、溃疡性结肠炎;今年2月12日,又新增一款间充质干细胞治疗注册申报获受理。
三、2个新药临床试验申请获批
截止目前,国内已经有2款干细胞新药IND获得了批准,均属于间充质干细胞治疗产品,适应症分别为膝骨关节炎和糖尿病足溃疡。
四、国拨经费近25亿元
2016年至2018年,中央财政已经连续3年拨款总计20亿元支持“干细胞及转化研究”重点专项,(2016年4.8759亿、2017年9.4021亿、2018年5.8544亿),共支持了98个项目。
2019年,国家再拨4亿元,支持12个干细胞研究方向。
当前,中央财政经费拨款支持的干细胞临床研究涉及黄斑变性、脊髓损伤、移植物抗宿主病、心衰、心肌梗死、肝病、重症急性肾损伤等多种疾病。
2019年国家继续支持针对神经、呼吸、消化系统或皮肤等方面某一种重大疾病或损伤,利用临床级干细胞产品进行细胞治疗的临床研究。

五、展望
近年来,随着研究取得进展以及监管路径的逐渐清晰,我国干细胞临床转化出现了新的发展局面,这激起了更多的患者对干细胞临床应用的呼唤。
如今,干细胞治疗在国内正慢慢从实验室走向临床,以上列举的数据只是现阶段的,相信之后会有更多的临床研究项目完成备案,也会出现更多的注册申报,进而获得临床批件,最后走向审批上市!

END
部分图文来自网络,侵删









